Additivt produserte medisinske implantater i 2025: Transformering av pasientbehandling og akselerasjon av markedsutvidelse. Utforsk hvordan 3D-printing revolusjonerer implantatdesign, produksjon og adopsjon i løpet av de neste fem årene.
- Sammendrag: Nøkkeltrender og Markedsutsikter (2025–2030)
- Markedsstørrelse, Vekstrate og Prognoser: 2025–2030
- Teknologiske fremskritt innen additiv produksjon for implantater
- Store aktører og strategiske partnerskap (f.eks. Stryker, Zimmer Biomet, EOS, GE Additive)
- Regulatorisk landskap og standarder (FDA, ISO, ASTM)
- Materialinnovasjoner: Metaller, polymere og bio-keramikk
- Kliniske applikasjoner: Ortopedi, tannleger, kraniofacial og mer
- Forsyningskjede, tilpasning og produksjonsskalerbarhet
- Utfordringer: Biokompatibilitet, validering og refusjon
- Fremtidsutsikter: Nye markeder, FoU og forventet CAGR (2025–2030)
- Kilder & Referanser
Sammendrag: Nøkkeltrender og Markedsutsikter (2025–2030)
Additivt produserte (AM) medisinske implantater er i ferd med å vokse betydelig og gjennomgå transformasjon mellom 2025 og 2030, drevet av fremskritt innen 3D-printing teknologier, reguleringsprogresjon og økende klinisk adopsjon. Sektoren preges av et skifte fra prototyping og tilpassede kirurgiske guider til rutinemessig produksjon av pasientspesifikke implantater, spesielt innen ortopedi, kranio-maxillofacial, tannlege og spinalapplikasjoner.
Nøkkelaktører i bransjen som Stryker, Zimmer Biomet, og DePuy Synthes (et Johnson & Johnson-selskap) utvider sine porteføljer av 3D-printede implantater, og utnytter proprietære teknologier for å forbedre osseointegrasjon, redusere kirurgiske tider og forbedre pasientresultater. For eksempel, Strykers Tritanium og Zimmer Biomets Trabecular Metal-teknologier brukes nå mye i hofte- og kneproteser, med pågående kliniske studier som støtter deres langsiktige effektivitet.
Det regulatoriske landskapet utvikler seg for å imøtekomme de unike utfordringene ved AM-implantater. Den amerikanske mat- og legemiddeladministrasjonen (FDA) har utgitt retningslinjer for tekniske vurderinger for additiv produksjon av medisinske enheter, og Den europeiske unions medisinske enhetsregulering (MDR) refererer i økende grad til AM-spesifikke standarder. Denne regulatoriske klarheten forventes å akselerere godkjenningen og adopsjonen av nye enheter frem til 2030.
Materialinnovasjon er en annen viktig trend. Titanlegeringer forblir det dominerende materialet for belastbare implantater, men det er økende interesse for bioresorberbare polymerer og keramikk for midlertidige eller pediatriske applikasjoner. Selskaper som GE Additive og Renishaw investerer i nye pulverbedsfusions- og elektronbølgemeltingssystemer for å muliggjøre finere gitterstrukturer og mer komplekse geometrier, som er vanskelige eller umulige å oppnå med tradisjonell produksjon.
Utsiktene for 2025–2030 inkluderer bredere adopsjon av digitale arbeidsflyter, fra bildedanning og design til produksjon på stedet. Sykehus og spesialiserte sentre begynner å installere interne 3D-printing kapasiteter, støttet av partnerskap med teknologileverandører som Materialise og Stratasys. Denne trenden forventes å redusere ledetider, lavere kostnader, og ytterligere personliggjøre pasientbehandling.
Totalt sett vil de neste fem årene sannsynligvis se additivt produserte medisinske implantater bevege seg fra nisje til mainstream, med økende bevis på kliniske fordeler, utvidende regulatorisk aksept og et voksende økosystem av leverandører og helseleverandører som omfavner teknologien.
Markedsstørrelse, Vekstrate og Prognoser: 2025–2030
Markedet for additivt produserte (AM) medisinske implantater er i ferd med å oppleve solid vekst i 2025 og de påfølgende årene, drevet av teknologiske fremskritt, regulatoriske godkjenninger og økt klinisk adopsjon. I 2025 anslås den globale markedsstørrelsen for 3D-printede medisinske implantater å overstige flere milliarder USD, med ortopedi, tannlege, og kranio-maxillofacial segmentene som leder an. Den sammensatte årlige vekstraten (CAGR) for sektoren forventes å forbli i tosifret gjennom 2030, noe som gjenspeiler både utvidede kliniske indikasjoner og inntreden av nye aktører.
Nøkkelaktører i bransjen som Stryker, Zimmer Biomet, og DePuy Synthes (et Johnson & Johnson-selskap) fortsetter å investere tungt i additiv produksjonskapasiteter. Strykerts AMagine-plattform, for eksempel, støtter en voksende portefølje av 3D-printede titanium spinal- og leddimplantater, med økt adopsjon rapportert i Nord-Amerika og Europa. Zimmer Biomet har utvidet sin Trabecular Metal-teknologi, og utnytter additiv produksjon for forbedret osseointegrasjon og pasientspesifikke løsninger. DePuy Synthes fortsetter å utvide sitt tilbud av 3D-printede implantater, spesielt innen personlig ortopedi og traume-segmentene.
Tannimplantater representerer et annet høyvekstområde, med selskaper som Dentsply Sirona og Straumann som integrerer additiv produksjon i sine arbeidsflyter for tilpassede abutments og protetikk. Adopsjonen av metalladditiv produksjon, spesielt med titan- og kobolt-krom legeringer, akselererer på grunn av forbedrede materialegenskaper og regulatoriske godkjenninger.
Regulatoriske organer, inkludert den amerikanske mat- og legemiddeladministrasjonen (FDA) og det europeiske legemiddelbyrået (EMA), har utgitt oppdaterte retningslinjer og rammer for 3D-printede medisinske enheter, som strømlinjeformer veien for godkjenning av nye produkter. Denne regulatoriske klarheten forventes å ytterligere katalysere markedsvekst frem til 2030, ettersom flere pasientspesifikke og komplekse implantater når kommersialisering.
Ser vi fremover, er markedsutsiktene fortsatt svært positive. Sammensmeltingen av digital helse, avansert bildebehandling og additiv produksjon muliggjør produksjon av høytilpassede implantater i stor skala. Bransjeanalytikere forventer at additivt produserte implantater innen 2030 vil utgjøre en betydelig andel av det samlede markedet for medisinske implantater, spesielt innen ortopedi, tannlege og kraniofaciale applikasjoner. Inntreden av nye produsenter og utvidelse av etablerte aktørers porteføljer forventes å intensivere konkurransen og drive innovasjonen, som til slutt vil komme pasientresultater og helsevesensystemer verden over til gode.
Teknologiske fremskritt innen additiv produksjon for implantater
Landskapet for additivt produserte (AM) medisinske implantater opplever rask teknologisk utvikling fra og med 2025, drevet av fremskritt innen materialvitenskap, prosesskontroll og regulatorisk aksept. Integrasjonen av additiv produksjon—vanligvis kjent som 3D-printing—i medisinske implantater muliggjør produksjon av høyt tilpassede, pasient-spesifikke enheter med komplekse geometrier som tidligere var uoppnåelige med tradisjonelle produksjonsmetoder.
En av de mest betydningsfulle teknologiske fremskrittene er forbedringen av metalladditiv produksjonsteknikker, spesielt selektiv laser smelting (SLM) og elektronbølgemelting (EBM). Disse prosessene brukes nå rutinemessig til å lage implantater fra biokompatible metaller som titanlegeringer og kobolt-krom, som tilbyr overlegen osseointegrasjon og mekaniske egenskaper. Selskaper som Smith+Nephew og Stryker har etablert dedikerte AM-produksjonslinjer for ortopediske implantater, inkludert acetabularkopper og spinalbur, og utnytter gitterstrukturer for å fremme benvekst og redusere implantatvekten.
Polymerbasert AM utvikler seg også, med høypresterende materialer som polyetereterketon (PEEK) som i økende grad brukes til kraniale, tannlegeklinikker og spinalimplatanter. Evonik Industries er en ledende leverandør av medisinske PEEK-filamenter og pulvere, som støtter utviklingen av lette, radiolucente implantater som kan tilpasses individuell pasientanatomi.
En annen viktig trend er integrasjonen av digitale arbeidsflyter, fra bildebehandling og design til produksjon og etterbehandling. Bruken av AI-drevet designprogramvare og automatiserte kvalitetskontrollsystemer strømlinjeformer produksjonen av pasient-spesifikke implantater, reduserer ledetider og forbedrer reproducerbarhet. GE HealthCare og Materialise er i fronten av å tilby digitale plattformer som kobler medisinsk bildebehandling, kirurgisk planlegging og AM-produksjon, og muliggjør sømløst samarbeid mellom klinikere og produsenter.
Regulatoriske organer anerkjenner i økende grad de unike utfordringene og mulighetene som AM-implantater presenterer. Den amerikanske mat- og legemiddeladministrasjonen (FDA) har utgitt veiledningsdokumenter og godkjent flere 3D-printede implantater for klinisk bruk, noe som baner vei for bredere adopsjon. I Europa former den medisinske enhetsreguleringen (MDR) kvalitets- og sporbarhetsstandarder for AM-enheter, med organisasjoner som EOS og Renishaw som aktivt engasjerer seg i samsvars- og sertifiseringsprosesser.
Ser vi fremover, forventes de neste årene ytterligere fremskritt innen fler-materialprinting, bioresorberbare stillas, og integrasjonen av sensorer i implantater for sanntidsovervåkning. Etter hvert som AM-teknologier modnes og regulatoriske veier blir klarere, er adopsjonen av additivt produserte implantater på vei til å akselerere, og tilbyr nye muligheter for personlig medisin og forbedrede pasientresultater.
Store aktører og strategiske partnerskap (f.eks. Stryker, Zimmer Biomet, EOS, GE Additive)
Landskapet for additivt produserte (AM) medisinske implantater i 2025 er preget av aktiviteten til flere store aktører og et voksende nettverk av strategiske partnerskap. Bransjeledere som Stryker, Zimmer Biomet, EOS, og GE Additive former fortsatt sektoren gjennom innovasjon, kapasitetsutvidelse og samarbeid.
Stryker forblir i frontlinjen, og utnytter sin proprietære AMagine-teknologi for å produsere et bredt utvalg av titanium ortopediske implantater, inkludert spinalbur og leddproteser. Selskapets dedikerte additiv produksjonsanlegg i Irland, ett av de største i verden, er sentralt i strategien for å øke produksjonen og akselerere introduksjonen av nye, pasientspesifikke enheter. Strykerts løpende investeringer i forskning og utvikling, samt partnerskap med sykehus og forskningsinstitusjoner, forventes å ytterligere utvide porteføljen av AM-implantater frem til 2025 og utover.
Zimmer Biomet er en annen nøkkelspiller, med et sterkt fokus på å integrere additiv produksjon i sine personlige løsninger for ortopedi og tannlegeimplantater. Selskapet har etablert samarbeid med teknologileverandører og akademiske partnere for å fremme design og regulatorisk godkjenning av komplekse, pasient-tilpassede implantater. Zimmer Biomets fortsatte investering i digitale arbeidsflyter og AM-aktiverte tilpasninger forventes å drive vekst i kirurgiske løsninger over de neste flere årene.
På teknologileverandørsiden er EOS en ledende leverandør av industrielle 3D-printingsystemer for medisinske anvendelser. Dets metalladditive produksjonsplattformer brukes mye av implantatprodusenter for å produsere høypresisjons, biokompatible komponenter. EOSs løpende partnerskap med medisinske enhetsselskaper og fokus på prosessvalidering og regulatorisk samsvar forventes å støtte bredere adopsjon av AM i medisinsk sektor frem til 2025.
GE Additive, en avdeling av General Electric, leverer avanserte metalladditiv produksjonsmaskiner og materialer til medisinindustrien. Selskapet samarbeider med implantatprodusenter for å optimalisere design, redusere ledetider, og muliggjøre produksjon av komplekse geometrier som er vanskelige eller umulige å oppnå med tradisjonelle metoder. GE Additives globale nettverk og ekspertise innen additiv prosessutvikling plasserer det som en kritisk mulighet for neste generasjon av medisinske implantater.
Ser vi fremover, er det sannsynlig at sektoren vil oppleve ytterligere konsolidering og tverrindustrielle partnerskap, ettersom etablerte medisinske enhetsselskaper søker å integrere AM-kapasiteter og teknologileverandører utvider sine tilbud. Den fortsatte tilpasningen av regulatoriske rammer og modningen av digitale designverktøy forventes å akselerere kommersialiseringen av additivt produserte implantater, med store aktører som leder an i innovasjon og markedsutvidelse.
Regulatorisk landskap og standarder (FDA, ISO, ASTM)
Det regulatoriske landskapet for additivt produserte (AM) medisinske implantater er raskt i utvikling i 2025, og gjenspeiler både modningen av 3D-printing-teknologier og den økende bruken av disse enhetene i klinisk praksis. Regulerende etater og standardorganisasjoner jobber for å sikre at AM-implantater oppfyller strenge sikkerhets-, effektivitets- og kvalitetskrav, samtidig som de tar hensyn til de unike utfordringene og mulighetene som additiv produksjon representerer.
I USA fortsetter den amerikanske mat- og legemiddeladministrasjonen (FDA) å spille en avgjørende rolle. FDAs veiledning fra 2017 om «Tekniske vurderinger for additivt produserte medisinske enheter» forblir et grunnleggende dokument, men byrået har siden utvidet sitt engasjement med interessenter gjennom workshops, pilotprogrammer og utvikling av nye utkast til veiledninger. I 2024 og 2025 har FDA fokusert på å klargjøre krav til pasient-matchede enheter, overvåking etter markedsføring, og validering av AM-prosesser, særlig for implantater som ortopediske og kraniofaciale enheter. FDAs senter for enheter og strålehelse (CDRH) samarbeider også med næringslivet for å finjustere tilnærminger for kvalitetskontroll og risikostyring spesifik til AM-arbeidsflyter.
Internasjonalt leder International Organization for Standardization (ISO) og ASTM International innsatsen for å harmonisere standarder for AM medisinske enheter. ISO/ASTM 52900 og relaterte standarder gir terminologi og generelle prinsipper, mens ISO 13485 forblir referansen for kvalitetsstyringssystemer i produksjon av medisinske enheter. I 2023–2025 har nye og reviderte standarder adressert emner som materialsporbarhet, prosessvalidering og overvåkning under produksjon—kritisk for å sikre reproducerbarhet og sikkerhet for AM implantater. ISO/ASTM 52920-standarden, publisert i 2023, adresserer spesielt kvalifikasjonsprinsipper for AM deler i medisinske anvendelser, og blir bredt vedtatt av produsenter.
Store implantatprodusenter, inkludert Stryker, Zimmer Biomet, og DePuy Synthes, engasjerer seg aktivt med regulatorer og standardiseringsorganer for å forme beste praksis. Disse selskapene har etablert dedikerte AM-anlegg og investerer i digitale kvalitetsstyringssystemer for å overholde de stadig skiftende regulatoriske forventningene. For eksempel har Strykerts AM-divisjon vært i forkant av å implementere prosesskontroller og sporbarhetstiltak som er i samsvar med både FDA- og ISO/ASTM-krav.
Ser vi fremover, forventes det regulatoriske utsiktene for AM medisinske implantater i de kommende årene å fokusere på sanntids prosessovervåkning, digital dokumentasjon og livssyklusledelse. Regulatorer vil sannsynligvis øke sin overvåking av programvare og dataintegritet i AM-arbeidsflyter, samt bruken av kunstig intelligens i design og kvalitetskontroll. Det pågående samarbeidet mellom næringsliv, regulatorer og standardorganisasjoner forventes å ytterligere strømlinjeforme godkjenningsprosessen for innovative AM-implantater, samtidig som høye standarder for pasientsikkerhet og produktprestasjon opprettholdes.
Materialinnovasjoner: Metaller, polymerer og bio-keramikk
Landskapet for additivt produserte (AM) medisinske implantater er raskt i utvikling i 2025, drevet av betydelige materialinnovasjoner innen metaller, polymerer og bio-keramikk. Disse fremskrittene muliggjør produksjon av implantater med forbedret biokompatibilitet, mekanisk ytelse, og pasientspecifik tilpasning.
Metaller forblir grunnlaget for AM-implantater, spesielt titanlegeringer som Ti-6Al-4V, som er verdsatt for sin styrke, korrosjonsmotstand og osseointegrasjonsegenskaper. I 2025 utvider ledende produsenter som Smith+Nephew og Stryker sine porteføljer av 3D-printede ortopediske og spinalimplantater, ved å dra nytte av gitterstrukturer og overflatebearbeiding for å fremme benvekst og redusere implantatvekten. GE fortsetter å levere avanserte additiv produksjonssystemer og metallpulvere, og støtter produksjonen av komplekse geometrier og pasient-spesifikke enheter. Det er også voksende interesse for nye legeringer, som beta-titan og kobolt-krom, som tilbyr skreddersydde mekaniske egenskaper for krevende applikasjoner.
Polymerer vinner frem for applikasjoner der fleksibilitet, radiolucens eller bioresorberbarhet er ønskelig. Høypresterende polymerer som PEEK (polyether ether ketone) blir additivt produsert for kraniale, spinal- og tannlegeimplantater, med selskaper som Evonik som leverer medisinske PEEK-pulvere og filamenter. Utviklingen av bioresorberbare polymerer, inkludert poly melkesyre (PLA) og polykaprolakton (PCL), gjør det mulig med midlertidige stillaser som gradvis brytes ned mens naturlige vev regenereres. I 2025 er fokuset på å forbedre trykkegenskapene og den mekaniske styrken til disse materialene, samt å inkludere legemiddellevering for infeksjonskontroll og forbedret helbredelse.
Bio-keramikk som hydroxyapatitt og tricalciumfosfat blir stadig mer brukt for sine osteokonduserende egenskaper, særlig i tannlege og maxillofacial implantater. Selskaper som CeramTec fremmer additiv produksjon av keramiske komponenter, og overvinne tradisjonell sprøhet gjennom innovative trykkmetoder og sammensatte formuleringer. Hybridimplantater, som kombinerer keramikk med metaller eller polymerer, dukker også opp for å utnytte fordelene ved flere materialklasser.
Ser vi fremover, forventes de kommende årene en ytterligere integrasjon av fler-materialprinting, som muliggjør fabrikasjon av implantater med graderte egenskaper og funksjonaliserte overflater. Regulatoriske organer tilpasser seg disse innovasjonene, med standarder som utvikler seg for å ta hensyn til de unike utfordringene ved AM-materialer. Etter hvert som materialvitenskap og additiv produksjonsteknologier smelter sammen, er sektoren på vei til fortsatt vekst, med pasientresultater og implantatets levetid i fokus for utviklingen.
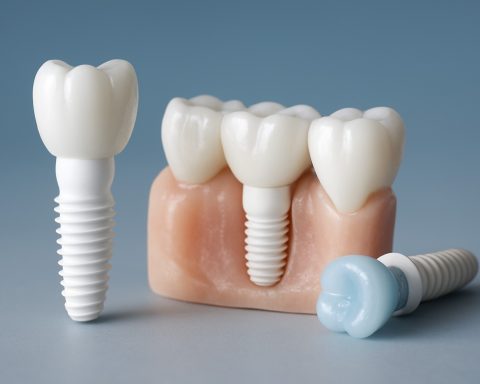
Kliniske applikasjoner: Ortopedi, tannlege, kraniofacial og mer
Additiv produksjon (AM), vanligvis kjent som 3D-printing, har raskt fremmet det kliniske landskapet til medisinske implantater, spesielt innen ortopedi, tannlege og kraniofaciale applikasjoner. Fra 2025 akselererer integrasjonen av AM-teknologier i kliniske arbeidsflyter, drevet av etterspørselen etter pasient-spesifikke løsninger, forbedrede kirurgiske resultater, og strømlinjeformede forsyningskjeder.
Innen ortopedi brukes nå additivt produserte implantater rutinemessig for komplekse leddproteser, spinalbur og traume-fiksasjonsenheter. Selskaper som Stryker og Zimmer Biomet har etablert dedikerte produktlinjer for 3D-printede titanium implantater, ved å dra nytte av gitterstrukturer som fremmer osseointegrasjon og reduserer implementasjonsvekten. Strykerts proprietære AMagine-teknologi, for eksempel, muliggjør produksjon av svært porete Tritanium-implantater, som nå er nært tilpasset i hofte- og ryggoperasjoner. Zimmer Biomets Trabecular Metal-teknologi, også produsert via additiv produksjon, er likt anerkjent for sine benlignende egenskaper og kliniske suksess i leddrekonstruksjon.
Tannimplantologi har sett en parallell transformasjon. Additiv produksjon tillater rask produksjon av tilpassede abutments, kroner, og til og med full-ark proteser tilpasset individuell pasientanatomi. Dentsply Sirona og Straumann er i fronten, med digitale arbeidsflyter som integrerer intraoral scanning, CAD/CAM-design og 3D-printing. Disse arbeidsflytene reduserer ventetider og forbedrer passform, noe som fører til høyere pasienttilfredshet og færre post-operative justeringer.
Kraniofacial rekonstruksjon er et annet område der AM gjør en betydelig innvirkning. Pasient-spesifikke implantater for kraniedefekter, maxillofacial traumer og medfødte misdannelser produseres nå ved hjelp av biokompatible metaller og polymerer. DePuy Synthes (et Johnson & Johnson-selskap) og Materialise samarbeider med kirurger for å designe og produsere tilpassede implantater og kirurgiske guider, noe som muliggjør presis anatomisk restaurering og reduserer operativ tid.
Ser vi fremover, forventes de neste årene å gi ytterligere regulatorisk klarhet og bredere klinisk adopsjon. Den amerikanske mat- og legemiddeladministrasjonen (FDA) og europeiske regulatoriske organer jobber aktivt med å utvikle retningslinjer spesifikke for additivt produserte implantater, noe som sannsynligvis vil strømlinjeforme godkjenningsprosessene og oppmuntre til innovasjon. I tillegg forventes fremskritt innen trykkbare biomaterialer og fler-materialprinting å utvide applikasjoner utover hardvev, inkludert bioresorberbare stillas og myke vevsimplantater. Etter hvert som AM-teknologier modnes, sette sammensmeltingen av digital planlegging, produksjon på stedet og personlig medisin seg til å redefinere standarder for behandling på tvers av flere medisinske disipliner.
Forsyningskjede, tilpasning og produksjonsskalerbarhet
Forsyningskjeden for additivt produserte (AM) medisinske implantater gjennomgår betydelig transformasjon i 2025, drevet av fremskritt innen digital produksjon, regulatorisk tilpasning, og økende klinisk etterspørsel etter pasient-spesifikke løsninger. Evnen til å produsere høyt tilpassede implantater på forespørsel omformer tradisjonelle forsyningsmodeller, med et økende antall sykehus og enhetsprodusenter som integrerer AM-kapasiteter enten internt eller gjennom spesialiserte partnere.
Nøkkelaktører i bransjen som Stratasys, Smith+Nephew, og Stryker utvider sine AM-porteføljer med fokus på ortopedi, kraniofacial, og tannlegeimplantater. Smith+Nephew har merkevist økt sin bruk av 3D-printing for porøse titanium ortopediske implantater, og benytter AM for å forbedre osseointegrasjon og pasientresultater. Stryker fortsetter å investere i sin proprietære AMagine-prosess, som støtter produksjon av komplekse, gitterstrukturerte implantater som er vanskelige å oppnå med konvensjonell produksjon.
Tilpasning er en sentral fordel med AM i medisinske implantater. Kirurger og klinikere kan nå samarbeide med ingeniører for å designe implantater tilpasset individuell pasientanatomi, ved å bruke digitale bildedata som grunnlag for design. Denne tilnærmingen er særlig verdifull i tilfeller med komplekse benfeil eller revisjonsoperasjoner. Stratasys og GE (gjennom sin GE Additive-divisjon) tilbyr maskinvare- og programvareplattformer som muliggjør denne høye graden av personifisering, og støtter både sentraliserte og distribuerte produksjonsmodeller.
Produksjonsskalerbarhet forblir en utfordring men er raskt i bedring. Adopsjonen av industrielle AM-systemer, som de fra EOS og 3D Systems, muliggjør høyere produksjon og konsekvent kvalitet, noe som er essensielt for å møte regulatoriske krav og store kliniske behov. Disse selskapene samarbeider også tett med regulatoriske organer for å standardisere prosesser og sikre sporbarhet gjennom hele forsyningskjeden.
Ser vi fremover, forventes de kommende årene å se ytterligere integrasjon av AM i sykehusforsyningskjeder, med noen store medisinske sentre som etablerer onsite 3D-printing laboratorier for hurtig produksjon av pasient-spesifikke implantater og kirurgiske guider. Partnerskap mellom enhetsprodusenter, AM-teknologileverandører, og helseinstitusjoner vil sannsynligvis bli dypere, og fremme innovasjon og redusere ledetider. Etter hvert som digitalt inventar og distribuerte produksjonsmodeller modnes, er sektoren på vei mot større motstandskraft og responsivitet, noe som til slutt forbedrer pasientbehandlingen og operasjonell effektivitet.
Utfordringer: Biokompatibilitet, validering og refusjon
Den hurtige adopsjonen av additivt produserte (AM) medisinske implantater i 2025 er ledsaget av en rekke vedvarende utfordringer, spesielt innen biokompatibilitet, validering og refusjon. Etter hvert som AM-teknologier som selektiv lasersmelting og elektronbølgemelting blir mer utbredt for å produsere pasient-spesifikke ortopediske, dentale og kraniofaciale implantater, forblir sikringen av sikkerheten og effektiviteten til disse enhetene en toppprioritet for produsenter og regulatorer.
Biokompatibilitet er en grunnleggende bekymring, ettersom de unike mikrostrukturer og overflatemorfologier som produseres av AM-prosesser kan påvirke kroppens respons til implantater. Ledende produsenter som Smith+Nephew og Stryker har investert i omfattende in vitro- og in vivo-testing for å demonstrere at deres 3D-printede titan- og PEEK-implantater møter eller overgår etablerte biokompatibilitetsstandarder. Imidlertid fortsetter mangelen på langtidseffektive kliniske data for mange AM-enheter, spesielt de med nye gitterstrukturer eller belegg, å utgjøre utfordringer for bred klinisk aksept. Regulatoriske organer som den amerikanske mat- og legemiddeladministrasjonen (FDA) har utgitt veiledningsdokumenter, men den stadig skiftende naturen av AM-materialer og prosesser betyr at produsenter må kontinuerlig validere produktene sine gjennom grundig testing og overvåking etter markedsføring.
Validering og kvalitetskontroll er ytterligere komplisert av den iboende variasjonen i AM-prosesser. I motsetning til tradisjonell subtraktiv produksjon kan AM introdusere variasjoner fra batch til batch i porøsitet, mekanisk styrke og overflatekjemi. Selskaper som GE HealthCare og Zimmer Biomet utvikler avanserte prosessovervåking og inline inspeksjonsteknologier for å sikre konsistens og sporbarhet. Bransjeorganisasjoner, inkludert ASTM International og International Organization for Standardization (ISO), oppdaterer aktivt standarder for AM medisinske enheter, men harmonisering på tvers av globale markeder forblir et pågående arbeid.
Refusjon er en annen betydelig hindring for bredere adopsjon av AM-implantater. Selv om de kliniske fordelene med pasient-spesifikke enheter—som bedre passform og redusert kirurgisk tid—blir anerkjent, krever betalere ofte solid bevis for kostnadseffektivitet før de godkjenner refusjon. Selskaper som Materialise samarbeider med helseleverandører for å generere reelle data og helsekonomiske analyser, med mål om å demonstrere verdiforslaget for AM-implantater. I de kommende årene vil utsiktene for refusjon sannsynligvis avhenge av produsentenes evne til å gi overbevisende kliniske og økonomiske bevis, så vel som viljen til regulatoriske og betalingsorganisasjoner til å tilpasse seg de unike egenskapene ved AM-teknologier.
Fremtidsutsikter: Nye markeder, FoU, og forventet CAGR (2025–2030)
Fremtidsutsiktene for additivt produserte (AM) medisinske implantater fra 2025 til 2030 er preget av rask ekspansjon, teknologisk innovasjon og økende adopsjon på tvers av både etablerte og nye markeder. Sektoren forventes å oppleve en solid sammensatt årlig vekstrate (CAGR) drevet av sammensmeltingen av regulatorisk støtte, materialfremskritt og den økende etterspørselen etter pasient-spesifikke løsninger.
Nye markeder i Asia-Stillehavet, Latin-Amerika og Midtøsten forventes å spille en avgjørende rolle i neste vekstfase. Land som Kina og India investerer sterkt i helsevesenets infrastruktur og digitale produksjonskapasiteter, med lokale produsenter og globale ledere som etablerer partnerskap og produksjonsanlegg. For eksempel har GE HealthCare og Siemens Healthineers begge utvidet sin tilstedeværelse i Asia, som støtter lokaliseringen av AM-implantatproduksjon og teknologi-overføring. Disse innsatsene komplementeres av regjeringinitiativer som tar sikte på å fremme innovasjon innen medisinske enheter og redusere avhengigheten av import.
På FoU-fronten intensiverer ledende selskaper sitt fokus på biomaterialer av neste generasjon og prosessoptimalisering. Stratasys og 3D Systems investerer i forskningssamarbeid med sykehus og akademiske institusjoner for å utvikle implantater med forbedret osseointegrasjon, antimikrobielle egenskaper, og bioresorberbarhet. I mellomtiden fremmer Smith+Nephew og Stryker proprietære AM-teknologier for ortopediske og kraniofaciale implantater, med fokus på pasient-spesifikke geometrier og raskere produksjonssykluser.
Det regulatoriske landskapet utvikler seg også for å imøtekomme de unike utfordringene og mulighetene ved AM-implantater. Organer som den amerikanske mat- og legemiddeladministrasjonen (FDA) og det europeiske legemiddelbyrået (EMA) oppdaterer retningslinjene for å strømlinjeforme godkjenningsprosessen for tilpassede og på forespørsel-implantater, som forventes å akselerere markedsinngang og adopsjonsrater. Dette regulatoriske momentumet speiles av bransjeorganer som ASTM International, som fortsetter å utvikle standarder for AM medisinske enheter, og sikrer sikkerhet og interoperabilitet.
Ser vi fremover, anslås det globale markedet for additivt produserte medisinske implantater å oppnå en CAGR i høy én-sifret frem til 2030, med ortopediske, tannlege- og spinalapplikasjoner som leder an. Integrasjonen av kunstig intelligens og digitale tvillingteknologier i design- og produksjonsarbeidsflyten forventes å ytterligere forbedre presisjon og skalerbarhet. Etter hvert som AM blir stadig mer integrert i helsevesenet over hele verden, vil de neste fem årene sannsynligvis vise et skifte fra nisjeapplikasjoner til mainstream-adopsjon, spesielt i regioner som prioriterer modernisering av helsevesenet og personlig medisin.
Kilder & Referanser
- Zimmer Biomet
- GE Additive
- Renishaw
- Materialise
- Stratasys
- Dentsply Sirona
- Straumann
- Smith+Nephew
- Evonik Industries
- EOS
- International Organization for Standardization
- ASTM International
- CeramTec
- 3D Systems
- GE HealthCare
- Siemens Healthineers